por Jessica Silva, M.Sc., Pesquisadora do CESS/COPPEAD
A partir do dia 23/08, quem acessar o site da Anvisa poderá participar de uma enquete sobre o uso, produção, distribuição e regulação dos medicamentos biológicos no âmbito das políticas públicas. Esse tipo de medicamento tem mudado a forma pela qual algumas doenças, como câncer, esclerose múltipla e artrite reumatóide, são tratadas. Impulsionados pelos avanços do ramo da biotecnologia, esses medicamentos tendem a oferecer tratamentos mais eficazes e em alguns casos, são o único tratamento existente para determinadas enfermidades.
Esses medicamentos têm recebido grandes investimentos nos últimos anos e estima-se que nos próximos 10 anos cerca de 50% dos fármacos em desenvolvimento serão biológicos¹. Agências como a Food and Drug Administration (FDA), agência regulatória americana, e a European Medicines Agency (EMA), agência europeia, já aprovaram o uso em humanos de mais de 1.000 fármacos dessa categoria¹.
Mas o que são e qual a diferença para os fármacos químicos? Esta e outras questões ainda em aberto têm sido objeto de estudo no CESS/COPPEAD.
Sem entrar em aspectos técnicos, de forma geral, medicamentos biológicos são formados por moléculas complexas obtidas a partir de células vivas (sejam elas microrganismos, animais ou plantas) através de processos biotecnológicos, como o uso de células geneticamente modificadas e fermentação microbiana.
Devido à complexidade do processo produtivo desses fármacos, esses medicamentos são produtos de alto custo e com alto investimento em pesquisa e desenvolvimento (P&D), e isso se reflete nos preços dos mesmos. Por exemplo, o medicamento mais vendido no mundo (em termos de receita), em 2017, foi o biológico Humira da AbbVie, laboratório spinoff da Abbot, que faturou US $ 18,4 bilhões no mundo todo. O preço mais baixo de duas ampolas do mesmo está em torno de R$ 8.400,00 .
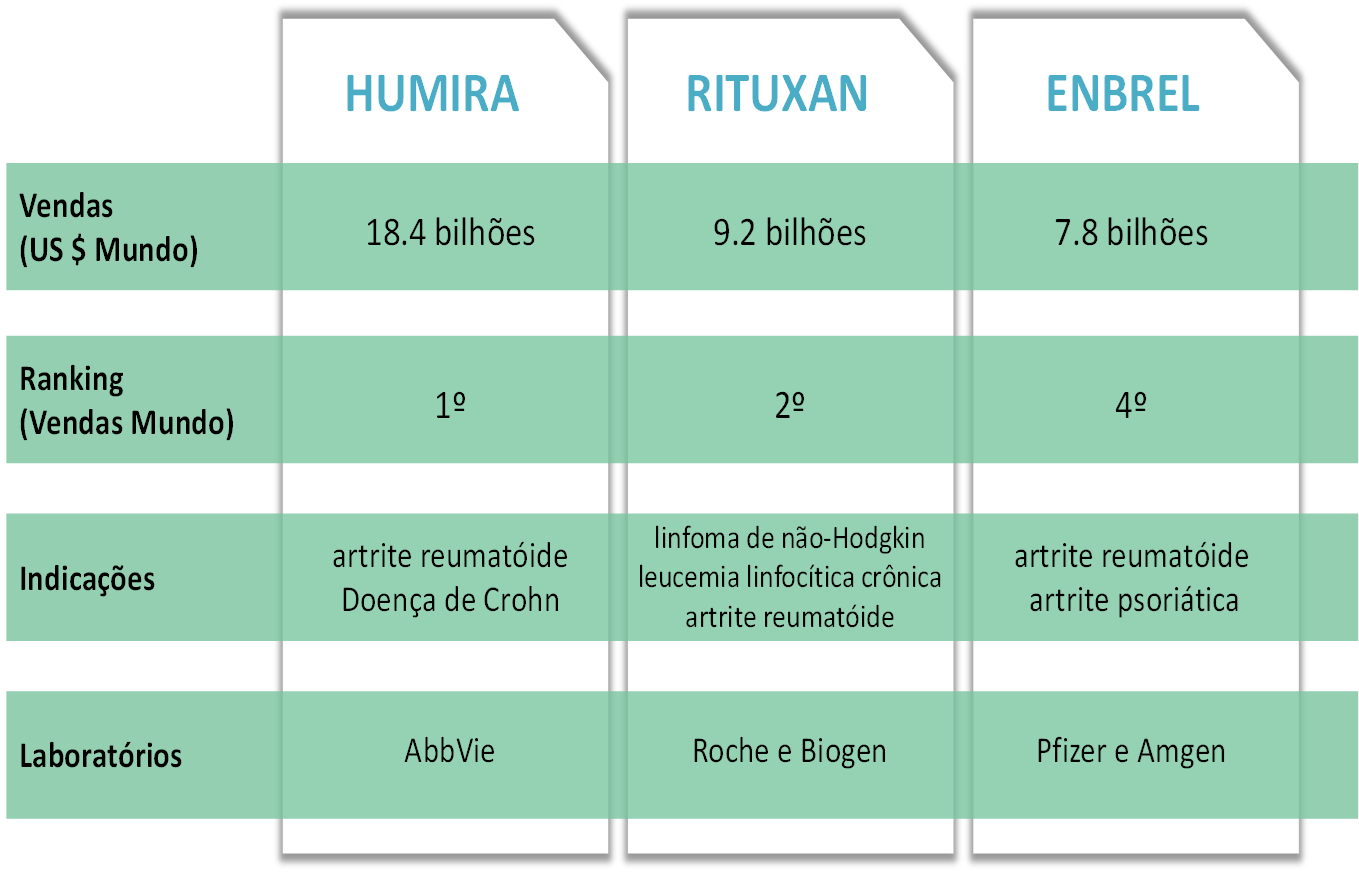
Uma questão bastante discutida é a ideia de produzir biológicos “genéricos”, que, análogo ao que ocorreu com os remédios químicos, seriam equivalentes aos de referência e teriam um custo muito mais baixo, barateando significativamente os produtos. Porém, diferente do que ocorre nos processos químicos, não é possível produzir um mesmo medicamento biológico de forma equivalente, pois uma mesma molécula pode ser sintetizada por diferentes técnicas e processos, de forma que um mesmo produto fabricado por empresas diferentes apresentará pequenas diferenças com relação ao fármaco de referência e também entre si (inclusive, lotes diferentes fabricados pela mesma empresa usando as mesmas técnicas apresentarão pequenas diferenças entre si). Esses produtos são apenas semelhantes ao biológico original e a esses fármacos dá-se o nome de biossimilar.
Além dessa diferença com relação às propriedades de um medicamento genérico químico, o processo de produção desses fármacos é um processo biológico, que é, além de naturalmente muito mais complexo, também muito mais custoso. As empresas que desejam produzir um remédio biológico, portanto, mesmo que não façam o investimento para a identificação e desenvolvimento da molécula, terão que fazer um investimento alto para conseguir desenvolver o processo de produção da mesma. Isso significa que o custo para produção de um biossimilar é menor que o do biológico de referência, porém não há o mesmo nível de redução que foi observado com o advento dos genéricos.
Além dessas categorias, há ainda os chamados “biomelhores”, que são fármacos melhorados, que apresentam propriedades terapêuticas superiores aos fármacos de referência do qual se originaram. Resumidamente, no caso dos remédios biológicos (sejam eles de referência, biossimilares ou biomelhorados), a diferenciação está no processo produtivo e não na composição química.
Há muitas questões envolvendo esses produtos, como o acesso a esses medicamentos, o uso deles dentro do sistema público, a substituição dos de referência por biosimilares em um tratamento, sua regulação, etc. Além disso, como o Brasil se encontra nesse cenário? Como está a indústria farmacêutica nacional? E os desafios logísticos da manutenção e dispensação desses produtos? Como garantir que não haverá desperdícios ao longo do processo?
Essas são algumas das questões debatidas atualmente no setor e que têm despertado o interesse dos pesquisadores do CESS/COPPEAD.
Fontes:
¹ Jozala et. al, 2016, Biopharmaceuticals from microorganisms: from production to purification, Brazilian Journal of Microbiology, 47, p. 51-63
https://consultaremedios.com.br/humira/p
https://www.engenerico.com/diferencias-genericos-biosimilares/
https://www.biossimilaresbrasil.com.br/biossimilares/o-que-sao-medicamentos-biossimilares/
https://www.thebalance.com/top-biologic-drugs-2663233



